電離 度 - 電離平衡と電離定数(電離度と水素イオン濃度の関係)
縦伝導度 Longitudinal conductivity あるいは直接伝導度 Direct conductivity ということもある。
イオン濃度などの計算問題はその後です。
電離層での 電場と 電流の関係図 昼間の電離層電気伝導度の高さ分布例 黒線、 赤線、 青線がそれぞれ平行、 ペダーセン、 ホール伝導度を示している。
で紹介したように, 可逆反応において,正反応と逆反応の速度が等しくなった状態を 化学平衡( chemical equilibrium )という。
水溶液中でごく一部しか電離しない、つまり電離度が1に比べて極めて小さい塩基のことを弱塩基という。
例えば の一部が電離して と になる場合を考えてみます。
電離度が、濃度によらずほぼ1に近い値になる酸のことを強酸という。
, Conductivity and drift in the ionosphere, J. 電気伝導度は場所、時刻、季節、太陽活動度等により変化し、 例えば夜間には小さく特に電離層下部では数十分の1になり、 また、太陽活動度の変化に伴い数倍から10倍程度変化する。
。
ついでに弱塩基の電離平衡も見ておきます。
a pH 試験紙: pH 指示薬をろ紙にしみこませたもので,標準色と試料水をしみ こませた試験紙の示色とを比較する。
電離度を後回しにする方法もあります。
強酸の化学反応式は次のようになります。
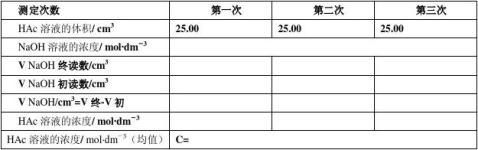
これは,電離していなくて,分子として存在している酢酸の濃度です。
これは覚えておくか、その場で導くことができるか、 難しい問題の部類に入るこの手の問題の答を導くためにはどちらかはできた方がいいです。
どちらでもかまわない。
電離度が、 濃度によらずほぼ1に近い値になる酸のことを 強酸といいます。
023となりますよ。
教科書によって強塩基と書いてあったり、強塩基からはずしてあったりする Ca OH 2なども、 電離度の定義によって強塩基というカテゴリーに分類されます。
同じ物質を水に溶かした場合も、濃度が異なれば、電離度の大きさも変化するのですね。
純粋な水,または希薄水溶液の中では,水分子の濃度 [ H 2 O ] はほぼ次の値をとり, 一定であるとみなす。
このような状態のことを 中性といいます。
電離度 電離度とは、溶液中で 溶質が電離する割合のことです。
しかし,酢酸に水酸化ナトリウム水溶液を加えていったときの中和滴定曲線には,もう一つ特徴があります。
- 関連記事
2021 lentcardenas.com