日本 の 製薬 会社 コロナ ワクチン - 海外の3社とコロナのワクチン契約を結んだ日本 効果と不安材料
手紙には次のことが示されていなければならない。
ワクチン開発に向けた取り組み 当社は、グループ会社のUMNファーマが有するBEVS 注1を活用した遺伝子組換えタンパクワクチンを開発しています。
一方、日本でもまったく動きがないわけではない。
昨年12月から新型コロナワクチンの接種を始めたアメリカでは、そう抗議する人が増えている。
この結果、海外が導入済みの新しいワクチンが日本にほとんど入ってこなくなったため、07年に厚生労働省はワクチン産業ビジョンを策定し、業界に構造転換を求めた。
さもなければ、残された手段は「チャレンジ試験」くらいしかありません。
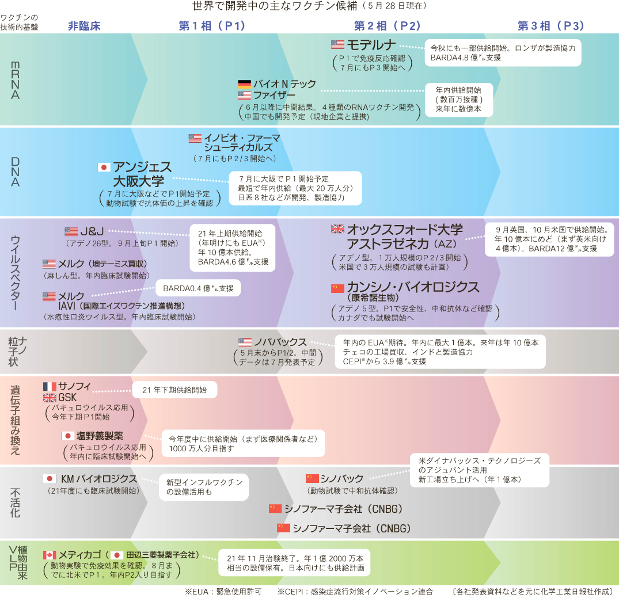
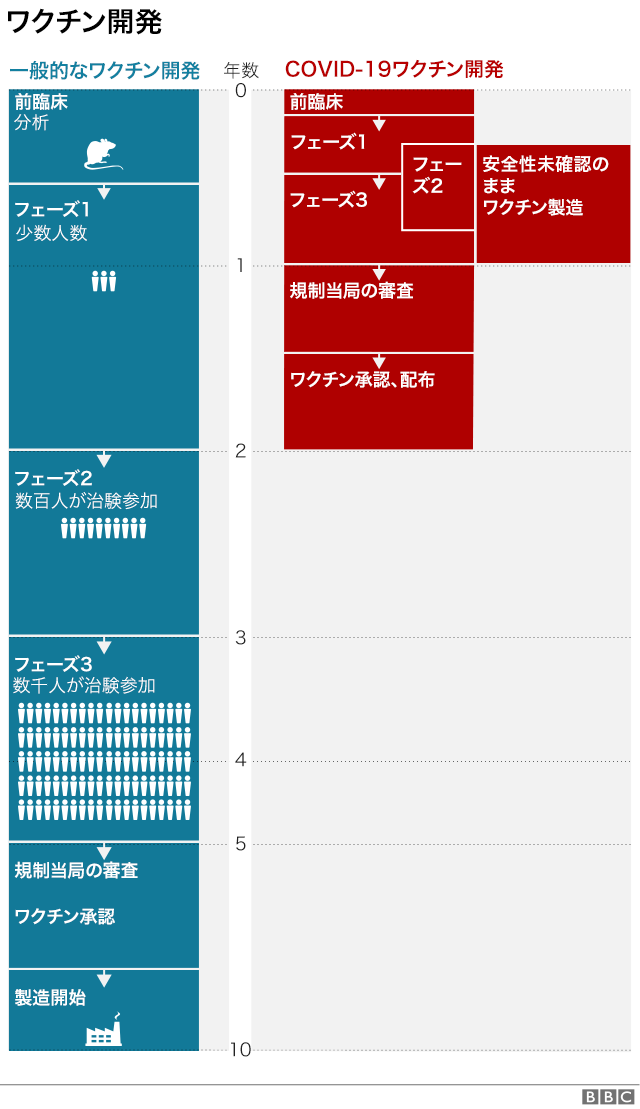
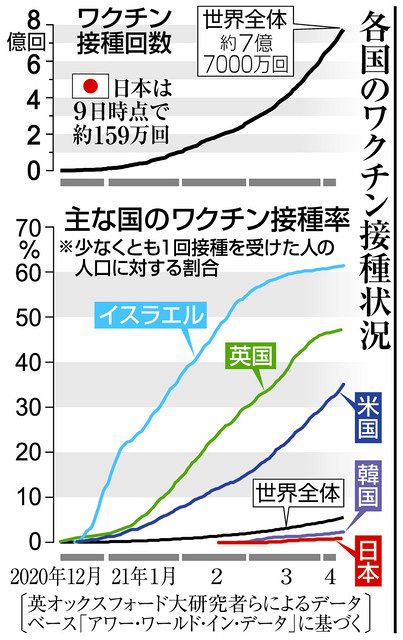
日本に先駆けて、世界各国で接種が始まった。
それほどの損失が仮に10年に1回出るとしたら、研究体制や生産体制の構築に、平時から毎年数千億円の規模で基盤整備を進めた方が安くないですか。
だが、UMNのインフルエンザワクチンに対して、日本で承認が下りることはなかった。
リモートワークの良いところは会社で仕事をしていると 同僚に話しかけられたり、どうでもいいミーティングに呼ばれたりして まとまった時間が取れず、集中力にかけてしまいますが 自宅だとそれがありません。
本年3月9日付にて厚生労働省より要請を受け、新型コロナウイルス感染症に対する治療薬の検討に資するべく、当社が国内での製造販売承認を有します吸入ステロイド喘息治療薬(一般名:シクレソニド)の供給体制を確保しております。
アストラゼネカは、日本向けのワクチンの多くを国内で製造する方針。
変異株への新型コロナワクチンの有効性 新型コロナウイルスの変異株は、基本的なウイルスの形や特徴は同じですが、従来のウイルスよりも感染力が強く、免疫機能が効きにくくなるといった可能性も考えられております。
そして、ウイルスをなるべく無毒化する中和抗体とウイルスを排除しようとする細胞性免疫がきっちり機能していることを確認したうえで、接種後の副反応や、発症した人の状況を細かくデータを取ってモニタリングすることを条件に仮承認するといった対策が必要ではないでしょうか。
ファイザーのワクチンは現在、16歳以上が対象となっていますが、海外で行われた臨床試験では12~15歳でも安全性と有効性が確認され、米FDAは12~15歳への緊急使用許可出しました。
遺伝子(mRNA)ワクチンの研究開発 AMEDが支援する「新型コロナウイルス(2019-nCoV)の制圧に向けての基盤研究」(研究代表者:東京大学医科学研究所 河岡義裕 教授)に参画し、当社が見出した新規核酸送達技術を用いた「新型コロナウイルス(2019-nCoV)に対するmRNAワクチン開発」を分担しています。
第一三共などが開発しているワクチンは、国内ですでに接種が始まっているファイザー製と同じウイルスの遺伝情報を伝える「mRNA」を使った仕組みです。
ワクチンは大規模接種センターなどで使用される予定で、9月までに2500万人分が供給され、その後についても国と2500万人分の供給について協議しているとしています。
- 関連記事
2021 lentcardenas.com



.jpg)