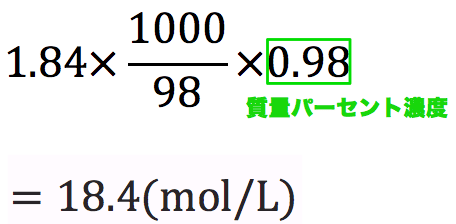モル 濃度 計算 - モル濃度・質量パーセント濃度・質量モル濃度!濃度計算のコツも解説! │ 受験メモ
次にモルを計算で導くことを考えます。
H 2SO 4の価数 反応単位 は2です。
5molとなります。
これは 水1molで18gあるという意味です。
そこでまずは溶媒1Lの単位をgに変換していきます。
モル濃度は溶質を[mol:モル]で考えていたのに対して、質量パーセントは溶質を[g:グラム]で考えるのです。
例えば、少量のエタノールを水に加えると、エタノールは溶質であり、水は溶媒である。
突然ですが、みなさんは化学のモル計算は得意でしょうか?化学基礎の中で最も厄介と言っても過言ではないモル。
濃度計算がわからなくなってしまうのは、 濃度の正確な定義やイメージが理解できておらず、 さらには計算の「型」を理解していないからです。
濃度変換は問題を解くときに何度も出てきますが、 結構苦手意識を持っている人も多いでしょう。
molからgへの変換に使うのがモル質量。
ここで、先ほどのクッキーの考えを使って考えてみましょう! クッキーの計算と同じように考えると、 水の質量が2倍に増えているので、36gの水の物質量は1molを2倍に増やした2molであることが分かりますね! このように、モルの計算は、「1molでどれくらいの量なのか」に着目して考えると、どのような計算をしなくてはならないのかが考えやすくなります! 今回紹介した「1molあたりの量がどれくらいなのか」を考えながら問題を解くと、化学のモル計算で計算式を立てやすくなります!みなさんも、モルの計算問題に取り組む際は、今回紹介した考えを思い出して、乗り切ってください! <この記事を書いた人> 横浜市立大学 国際総合科学部 先輩チューター なっち なんだかとってもクッキーが食べたくなってきました 笑. 溶液1Lに 1グラム当量が溶けている状態のことを 1規定 1N と呼びます。
。
使用するユニットは、化学溶液をどのように使用するかによって異なります。
さらにイオン濃度を求める問題にしてみますが、同じですよ。
濃度変換の方法 濃度の意味は理解できたでしょうか。
答えを瞬時に出せた人でも、次のように頭で考えたはずです。
(以下に解答と解説) 解答&解説 まずは水酸化ナトリウムNaOHの分子量を求めます。
「モル計算図」を参考にしながら、次の<基本編><応用編>を見ていきましょう。
(2)8gの酸素O 2は標準状態で何Lか。
キッチンにある小麦粉で何人分のクッキーが作れるでしょうか? この問題の答えは「2人分」ですよね! 答えを出すことは簡単ですが、ここで答えを出すプロセスを考えてみましょう。
これに関しては実際に自分でやってみて、 確認しておきましょう。
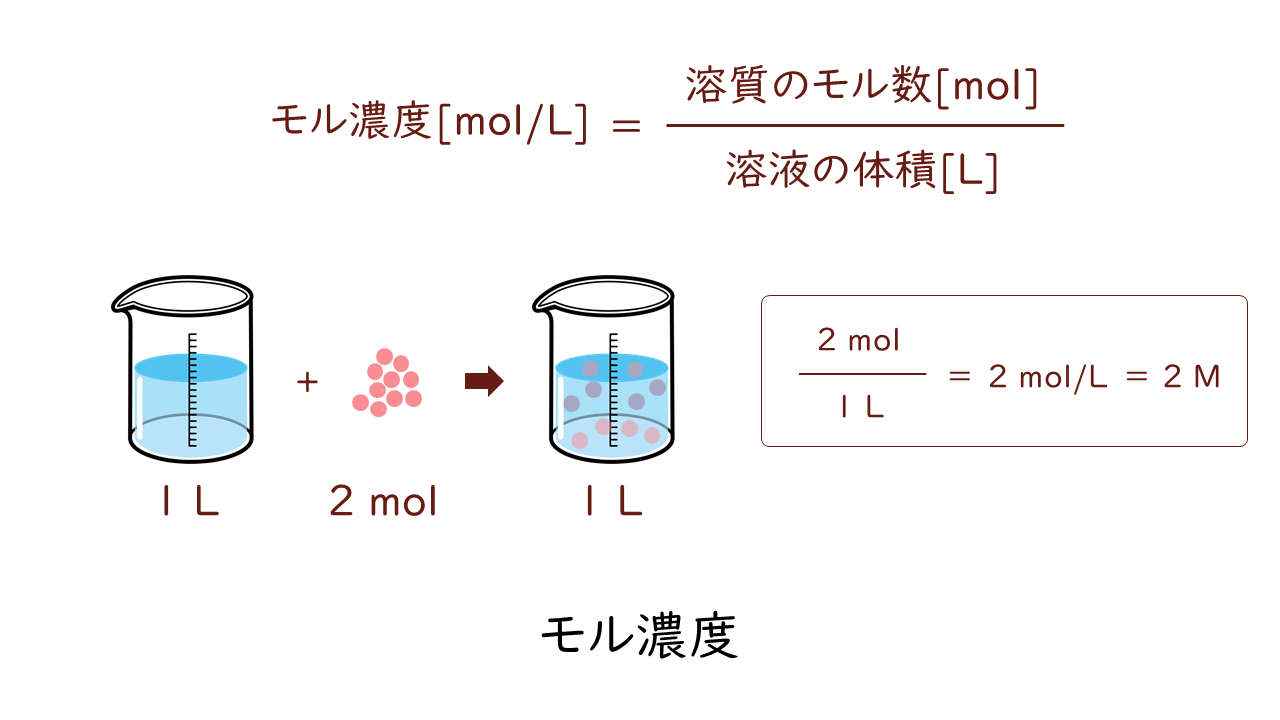
1:モル濃度とは?質量パーセントとの違いもわかる! まずは、モル濃度とは何かについて解説します。
ただし、水の分子量は18とします。
- 関連記事
2021 lentcardenas.com